PRACTICA PREANALITICA
Práctica-1 Operar equipo y material de laboratorio así como elaborar medios de cultivo.




Práctica-1 Operar equipo y material de laboratorio así como elaborar medios de cultivo.




La tinción de Gram o coloración Gram es un tipo de tinción diferencial empleado en microbiología para la visualización de bacterias, sobre todo en muestras clínicas. Debe su nombre al bacteriólogo danés Christian Gram, que desarrolló la técnica en 1884. Se utiliza tanto para poder referirse a la morfología celular bacteriana como para poder realizar una primera aproximación a la diferenciación bacteriana, considerándose Bacteria Gram positiva a las bacterias que se visualizan de color violeta y Bacteria Gram negativa a las que se visualizan de color rosa.
· Tinciones simples:
tinción negativa: se usa un colorante ácido, nigrosina o tinta china, que no entra en la célula de modo que estas no se observan teñidas, lo que se ve de color es el fondo.
Frotis.
Secado al aire
Colorante.
Visionado a 100X
tinción básica: se usa azul de metileno que si tiñe a las células.
Frotis.
Fijación.
Colorante.
Lavado con agua destilada.
Secado al aire.
Visionado a 100X.
Tinciones diferenciales:
tinción Gram: se basa en las diferencias entre las paredes de las Gram + y las Gram - , el primer colorante tiñe todas las células, en las G+ entra y con la acción del lugol formara una molécula muy grande que no sale de la célula, pero el disolvente, etanol, disolverá la capa d lipopolisacaridos de las Gram negativas donde esta el 1º colorante, ya que no pudo atravesar esta barrera, de modo que al añadir el 2º será este el único que les de color.
Extensión.
Fijación.
Colorante básico, cristal violeta, entra en las células.
Lavado con agua destilada.
Mordiente, lugol: el colorante básico ya no puede salir de G+.
Lavado con etanol que disuelve la capa de lipopolisacaridos de G- donde esta el 1º colorante.
Colorante de contraste básico, safranina o rojo metilo . que tiñe a las G-.
MEDIOS ENRIQUECIDOS
Sembrar es introducir artificialmente una porción de muestra en un medio adecuado, con el fin de iniciar un cultivo microbiano. Luego de sembrado, el medio de cultivo se incuba a una temperatura adecuada para el crecimiento. La siembra puede realizarse en medio líquido, sólido o semisólido, utilizando punta, ansa, hisopo o pipeta estéril.



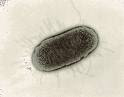
 mecios género Paramecium son protozoos ciliados con forma de suela de zapato o elipsoide, habituales en aguas dulces estancadas con abundante materia orgánica, como charcos y estanques. Son probablemente los seres unicelulares mejor conocidos y los protozoos ciliados más estudiados por la Ciencia. El tamaño ordinario de todas las especies de paramecios es de apenas 0'05 milímetros.
mecios género Paramecium son protozoos ciliados con forma de suela de zapato o elipsoide, habituales en aguas dulces estancadas con abundante materia orgánica, como charcos y estanques. Son probablemente los seres unicelulares mejor conocidos y los protozoos ciliados más estudiados por la Ciencia. El tamaño ordinario de todas las especies de paramecios es de apenas 0'05 milímetros.OBJETIVO:
1.- Es un instrumento para medir dimensiones de objetos relativamente pequeños, Se atribuye al cosmógrafo y matemático portugués que se llama:
:::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::::
R: Nombre: PIE DE REY

Descripción del Pie de Rey o Vernier. 121 palabras utilizaras para su descripción.
Consta de una "regla" con una escuadra en un extremo, sobre la cual se desliza otra destinada a indicar la medida en una escala. Permite apreciar longitudes de 1/10, 1/20 y 1/50 de milímetro utilizando el nonio. Mediante piezas especiales en la parte superior y en su extremo, permite medir dimensiones internas y profundidades. Posee dos escalas: la inferior milimétrica y la superior en pulgadas. Mordazas para medidas externas. Mordazas para medidas internas. Coliza para medida de profundidades. Escala con divisiones en centímetros y milímetros. Escala con divisiones en pulgadas y fracciones de pulgada. Nonio para la lectura de las fracciones de milímetros en que esté dividido. Nonio para la lectura de las fracciones de pulgada en que esté dividido. Botón de deslizamiento y freno.
 formado por bacilos gram negativos no desarrollan capsulo ni esporas.
formado por bacilos gram negativos no desarrollan capsulo ni esporas.
 de proteus normalmente no fermentan lactosa por razón de tener una b balactosidad pero algunas han demostrado capaces de hacerlo. Tienden hacer organismos pleomorficos, no espulorados, ni capsulados son productores de fenilalanina de saninasa.
de proteus normalmente no fermentan lactosa por razón de tener una b balactosidad pero algunas han demostrado capaces de hacerlo. Tienden hacer organismos pleomorficos, no espulorados, ni capsulados son productores de fenilalanina de saninasa.PESOS Y MEDIDAS
Tipos de bacterias que crecen en los medios de cultivo.
Observe que en la grilla de la cámara de Neubauer las áreas de recuento de eritrocitos y linfocitos son diferentes. Los glóbulos rojos se cuentan en las áreas coloreadas de rojo, mientras que los glóbulos blancos se cuentan en las áreas coloreadas de azul. Ten en cuenta que la grilla central tiene 25 cuadrados de 1mm x 1mm de área y 0.10 mm de profundidad. El factor de dilución es por tanto de 1:200. Convierte el número de glóbulos rojos contados en 5 cuadrados a nº glóbulos rojos/µl. (1 µl (microlitro) = 1 mm3 )
OBJETIVO:
 Luego pusimos un pedazo de lechuga y se veía bolitas o círculos juntos como si fueran gotitas de agua unidas.
Luego pusimos un pedazo de lechuga y se veía bolitas o círculos juntos como si fueran gotitas de agua unidas.
